科学探索奖得主姜长涛教授发现肠道菌源宿主同工酶,为糖尿病治疗
发表时间:2023-08-11 作者:澳尔华泰 阅读数:112023年7月17日,公布,10个不同领域的48名青年科学家每人获得300万元人民币奖金,其中医学科学领域的获奖者包括来自北京大学基础医学院的姜长涛教授。
2023年8月4日,姜长涛教授团队联合北京大学第三医院乔杰院士团队、北京大学化学学院雷晓光团队、美国国立卫生研究院Frank Gonzalez团队以及首都医科大学朝阳医院王广团队,在国际顶尖学术期刊 Science 上发表了题为:Microbial-host-isozyme analyses reveal microbial DPP4 as a potential antidiabetic target 的研究论文【1】。
该研究首次提出了肠道菌源宿主同工酶(Microbial-host-isozyme,MHI)的新概念,发现菌源宿主同工酶在肠道中的广泛存在,其中菌源DPP4(mDPP4)同工酶能够降解宿主活性GLP-1,破坏肠道屏障损伤小鼠的葡萄糖代谢。目前针对人源DPP4(hDPP4)的抑制剂(例如西格列汀,一种口服2型糖尿病治疗药物),对mDPP4的影响很小,揭示了西格列汀临床治疗响应性个体差异大的潜在原因。该研究还通过高通量筛选发现了首个对mDPP4具有高活性和高选择性的小分子抑制剂Daurisoline-d4(Dau-d4),可以通过特异性抑制mDPP4,改善糖尿病小鼠的糖耐量异常。
这项研究构建了从靶点发现到机制验证,再到药物筛选和疗效验证的全链条研究体系,为理解代谢性疾病的发生机制,提高代谢性疾病药物治疗效果,甚至发现新的治疗方法提供了可能。

姜长涛,2004年毕业于北京大学临床专业,2009年获得北京大学生理学博士学位,同年进入美国国立卫生研究院(NIH)进行博士后研究工作,2014年加入北京大学医学部基础医学院任研究员。主要研究方向包括肠道微生态及其代谢产物在代谢性疾病发病中的作用,神经酰胺代谢网络调控的机制。

姜长涛教授
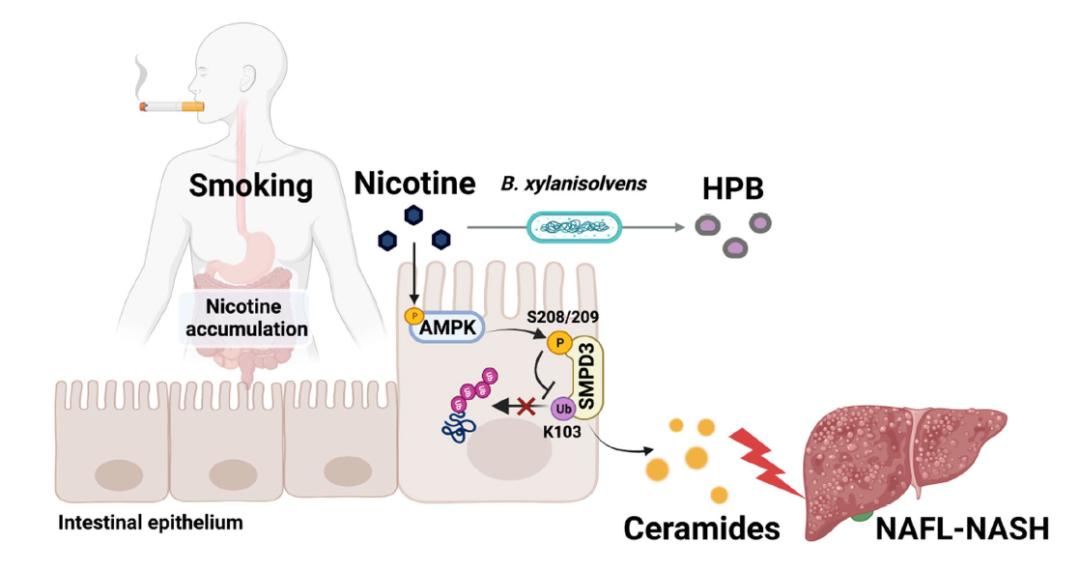
2022年10月19日,北京大学基础医学院姜长涛团队联合美国国立卫生研究院的Frank Gonzalez、浙江大学医学院第一附属医院虞朝辉、复旦大学基础医学院李洋、温州医科大学第一附属医院郑明华等人,在国际顶尖学术期刊 Nature 上发表了题为:Gut bacteria alleviate smoking-related NASH by degrading gut nicotine 的研究论文【2】。

这项发表在 Nature 的研究表明,吸烟过程中,尼古丁会在肠道中积累并加速非酒精性脂肪性肝病(NAFLD)的进展,但它可以被人体中的一种肠道细菌解木聚糖拟杆菌(Bacteroides xylanisolvens)有效降解。这种细菌与人类吸烟者的非酒精性脂肪性肝病(NAFLD)的严重程度呈负相关,还在小鼠模型中显示出了对吸烟相关脂肪肝疾病进展的保护作用。
这项研究首次发现哺乳动物体内有可降解尼古丁的肠道细菌,揭示了肠道中尼古丁积累的病理效应,并确定了一种内源性尼古丁降解肠道细菌,对预防和治疗吸烟者的非酒精性脂肪性肝炎(NASH)等吸烟相关肝脏疾病具有潜在应用价值。
肠道微生物群可以通过产生与宿主功能相似的酶来调节宿主的生理和病理生理。然而,由于在不同物种中具有相似功能的酶可能缺乏序列保守性,因此很难通过基于测序的研究来鉴定这些微生物-宿主同工酶。基于活性的功能蛋白筛选框架对于发现和表征此类微生物-宿主同工酶更为可靠,这将有助于更深入地了解肠道微生物-宿主相互作用。
为了鉴定潜在的微生物-宿主同工酶,研究团队建立了一个酶活性筛选平台,包括了对110种在各种人类疾病中起作用的酶的活性测定。这些酶的活性是在粪便来源的体外细菌群落中测定的。二肽基肽酶4(DPP4)是其中筛选到的一种重要的微生物-宿主同工酶,但其对宿主的病理生理作用仍知之甚少。研究团队尝试肠道微生物来源的DPP4是否能像宿主DPP4(hDPP4)一样降解活性GLP-1,从而影响血糖稳态。
通过人体肠道细菌分离和DPP4活性筛选,研究团队发现微生物DPP4主要由拟杆菌属细菌(Bacteroides spp)产生,肠道细菌来源的DPP4(mDPP4)能在体外降解活性GLP-1。然而,mDPP4不能影响正常喂食小鼠的GLP-1活性水平,但可以降低高脂饮食喂养小鼠或葡聚糖硫酸钠/吲哚美辛处理小鼠的GLP-1活性并损害葡萄糖稳态,这表明mDPP4需要破坏肠道屏障才能影响宿主GLP-1活性。
该研究还发现,宿主DPP4(hDPP4)抑制剂西格列汀无法有效抑制菌源DPP4(mDPP4)的活性。如果患者体内菌源DPP4(mDPP4)富集,将会降低西格列汀的临床治疗效果。这一发现揭示了西格列汀临床响应性的个体差异的机制,并找到了关键的作用靶点。
为了确定菌源DPP4(mDPP4)的选择性抑制剂,研究团队进一步高通量筛选了约107000个化合物,并通过结构修饰鉴定出Daurisoline的衍生物Daurisoline-d4(Dau-d4),Dau-d4可以选择性抑制菌源DPP4(mDPP4)的活性,提高糖尿病小鼠活性GLP-1水平,改善葡萄糖代谢,与西格列汀合用可进一步改善血糖稳态。这也为后续的基础研究和临床治疗提供了新的研究思路和方向。
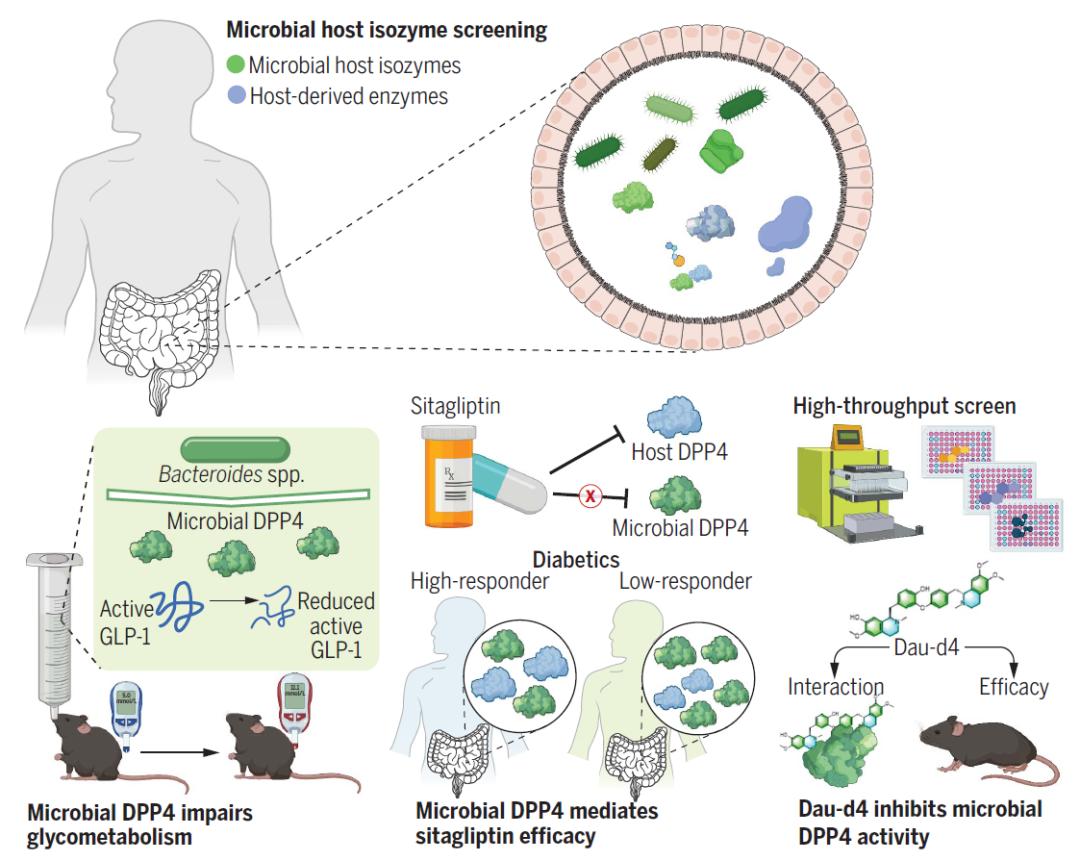
总的来说,该研究开发了一种鉴定未表征的肠道微生物-宿主同工酶的新策略,从而更深入地了解肠道微生物-宿主相互作用。该研究首次提出了肠道菌源宿主同工酶(Microbial-host-isozyme,MHI)的新概念,发现了肠道菌源DPP4同工酶可破坏宿主葡萄糖稳态,菌源DPP4(mDPP4)活性的变化可能导致2型糖尿病患者对西格列汀的异质反应。这些发现也强调了开发针对宿主和肠道微生物酶的治疗方法以获得更大临床疗效的希望。
这项研究构建了从靶点发现到机制验证,再到药物筛选和疗效验证的全链条研究体系,为理解代谢性疾病的发生机制,提高代谢性疾病药物治疗效果,甚至发现新的治疗方法提供了可能。
北京大学医学部博士后汪锴、基础医学院博士生张志威、北京大学第三医院杭婧副研究员、首都医科大学附属朝阳医院刘佳教授、北京大学化学学院博士郭富生为论文共同第一作者;北京大学医学部教授、北京大学第三医院特聘教授姜长涛,北京大学第三医院乔杰院士,北京大学化学学院雷晓光教授,美国国立卫生研究院Frank Gonzalez研究员,首都医科大学附属朝阳医院王广教授为论文共同通讯作者。
论文链接:
1. https://www.science.org/doi/10.1126/science.add5787
2. https://www.nature.com/articles/s41586-022-05299-4